Нейробиология зависимости
1.
Если в нашем геноме затаились кое-какие проблемные гены, мы с большой вероятностью станем аддиктами, причем относительно рано, и зависимость наша будет протекать тяжело и беспросветно. А если гены в порядке? Это тоже ничего не гарантирует: воздействие достаточно высоких доз наделенных аддиктивным потенциалом веществ в течение длительного времени способно сделать нас зависимыми даже при «благополучном» геноме. Неважно, с каким набором карт мы вступаем в аддиктивную игру. Неважно, какое вещество мы вытянули из заманчиво блестящей кучи. И в том, и в другом случае мы запускаем нейроадаптивные процессы в определенных мозговых структурах. Эти процессы, при плохом раскладе, способны образовать так называемый аддиктивный цикл – нейробиологическую суть зависимости.
2.
Мозг человека состоит из 86 млрд нейронов, «общающихся» между собой электрическими сигналами через триллионы соединений. Эти соединения называются синапсами. Синапс состоит из пресинаптической и постсинаптической мембран. Пространство между мембранами называется синаптической щелью. Пресинаптическая мембрана при возбуждении нейрона выделяет специальные вещества – нейротрансмиттеры. Глутамат, ГАМК, дофамин, серотонин, норадреналин – это нейротрансмиттеры. Постсинаптическая мембрана имеет рецепторы к этим веществам. Когда молекула нейротрансмиттера взаимодействует с рецептором, нервный сигнал передается из одного нейрона другому. Главный нейротрансмиттер системы вознаграждения – дофамин.
Все аддиктивные вещества способны вызывать чувство удовольствия. Да, каждое из них вызывает еще и свои специфические эффекты. И, да, отношение между интенсивностью удовольствия и величиной аддиктивного потенциала нелинейно (другими словами, вещество, вызывающее наиболее интенсивное удовольствие, не обязательно должно занимать первое место в конкурсе аддиктивности). Но аддиктивным вещество делает именно его способность прямо или косвенно воздействовать на нейроны системы вознаграждения – фундаментального регулятора нашего поведения.
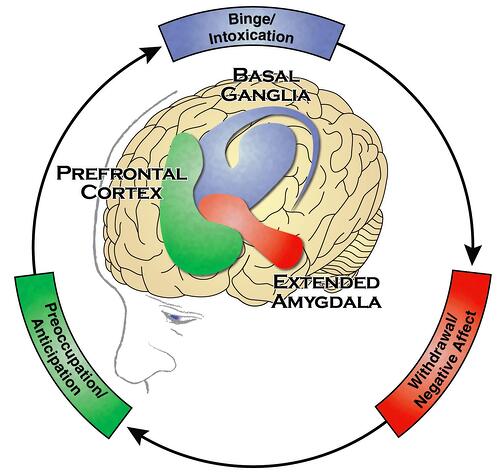
Вся наша поведенческая жизнь укладывается в формулу триггер – поведение – вознаграждение. Прилежащее ядро (лат. и англ. nucleus accumbens) – ключевое звено системы вознаграждения. Дорсальная область полосатого тела (лат. corpus striatum, pars dorsalis; англ. dorsal striatum) – ключевое звено в формировании привычек.
Вознаграждение мы переживаем как в форме предвкушения (желания, wanting), так и в форме удовольствия (liking). Wanting – форма мотивации, генерируемой обширными нейронными системами, частью которых является мезолимбическая дофаминовая система. Liking обусловлено активностью более мелких и хрупких нейронных систем и, похоже, зависит не столько от дофамина, сколько от энкефалинов. То, что в основе wanting и liking лежат разные механизмы, впервые предположили Кент Берридж и Терри Робинсон. Эта гипотеза была подтверждена и на лабораторных животных, и на людях. В прилежащем ядре примерно 90% wanting- и 10% liking-клеток. Остановитесь здесь и убедитесь, что поняли важность вышесказанного: хочу и нравится – это разные явления, причем разные они даже на уровне нейронов. Теперь смотрите, в чем именно важность: потребление ПАВ приводит к стимуляции только wanting-нейронов. Из-за этого wanting усиливается, тогда как liking не только не усиливается, но даже постепенно сходит на нет. Таким образом, можно сказать, что зависимость – это не проблема удовольствия, а проблема желания. Лимбическая сила, вон оно как! – скажете вы в сердцах. И будете правы. С годами голод по ПАВ все сильнее и сильнее, а удовольствия от употребления меньше и меньше – вот она, мякотка аддиктивной нейродрамы.

Теория Берриджа и Робинсона в целом сводится именно к этому: зависимое поведение возникает из-за функционального рассогласования между wanting- и liking-нейронами: по мере употребления ПАВ подопытные мыши (и люди) все больше want и все меньше like. И единственным способом унять wanting и повысить liking зависимые видят в продолжении употребления ПАВ, причем им приходится повышать дозу для получения желаемого уровня liking.
Дофаминовые системы не просто стимулируются, а сенситизируются. Сенситизация выражается в изменении морфологии нейронов, например, формы и количества дендритных шипиков (вспоминаем транскрипционные факторы NFκB и MEF2 из предыдущей главы). При этом wanting-нейроны становятся гиперреактивными к ПАВ и любым сигналам, сулящим получение ПАВ (drug cues): к рейнвейнской рюмке, запаху табачного дыма, музыке в стиле гоа-транс. В дальнейшем при воздержании от ПАВ сенситизированные нейроны не все время гиперактивны, конечно же. Но они могут становиться таковыми в триггерных ситуациях. Однажды вызванная, сенситизация очень длительна и, возможно, пожизненна.
Джордж Куб, директор NIAAA, и Нора Волкоу, директор NIDA, развили и дополнили концепцию Берриджа и Робинсона. В исследованиях, проведенных под их руководством, было показано, что чрезмерная активация нейронов nucleus accumbens приводит к нейроадаптивным изменениям как внутри системы вознаграждения, так и в других системах мозга (таких, как амигдала и префронтальная кора). Внутрисистемные нейроадаптации касаются рецепторов: вызванные психоактивными веществами многократные избыточные выбросы дофамина приводят к компенсаторному снижению плотности дофаминовых рецепторов на постсинаптической мембране. Ну, чтобы как-то смягчить дофаминовую атаку. И что в этом плохого? А то, что в отсутствие ПАВ дофамин теперь связывается с меньшим количеством рецепторов. На уровне субъективных переживаний это приводит к неудовлетворенности, недовольству, ангедонии.
Теперь о дорсальном стриатуме – главной структуре системы привычек (habit circuitry). В какой-то момент потребность в заветном веществе становится не просто сильной, а навязчивой, компульсивной: сам человек внутри себя может быть против употребления, но его будто никто не слушает – есть привычка, сильная и навязчивая, и ее нужно день за днем поддерживать. Не хочу, а уже надо, и это надо будто живет своей собственной жизнью. Причем навязчивое надо продолжается даже после перехода в трезвость. Абстиненты много месяцев подряд замечают у себя смутную, временами усиливающуюся потребность что-то делать и «зацикливаются» на том или ином поведении: часами играют в видеоигры, запойно погружаются в сериалы, с головой уходят в спорт, не совсем понимая, что следуют компульсивному зову, примерно такому же, который управлял их поведением во времена употребления ПАВ.
Итак, в основе сильного, непреодолимого влечения к ПАВ лежит сенситизация (морфофункциональные изменения) дофаминовых нейронов прилежащего ядра. При этом уровень удовольствия (liking) не только не растет, но даже снижается. Параллельно с этим в дело вовлекаются нейроны дорсального стриатума, прочно встраивая поиск и употребление ПАВ в габитуальный план жизни.
3.
Помимо прилежащего ядра и полосатого тела, в какой-то момент на аддиктивную сцену выходит амигдала (лат. corpus amygdaloideum, англ. amygdala). Это парная миндалевидная структура – по одной штуке в каждой височной доле. Амигдала играет ключевую роль в формировании эмоций (в частности, страха), запоминании эмоционально окрашенных событий и принятии решений. Как видно, амигдала – один из топ-менеджеров нашего поведения.
Нейроны амигдалы содержат большое количество рецепторов к кортикотропин-рилизинг-фактору (КРФ), норадреналину, динорфинам – нейротрансмиттерам стресс-систем мозга. КРФ – полипептид, регулирующий гормональные, симпатические и поведенческие реакции на стрессоры. Многократное введение этанола, кокаина, героина, никотина и других ПАВ приводит к изменениям в нейротрансмиссии КРФ в амигдале таким образом, что при отмене этих веществ КРФ повышается. Субъективно подъем КРФ переживается как тревожность или аверсия (состояние «не нравится», «не хочу»).
Норадреналин обеспечивает поведенческий ответ во время стресса, возбуждая нейроны и фокусируя внимание на стрессоры. КРФ и норадреналин активируют друг друга.
Динорфины – пептиды, тропные к κ-опиоидным рецепторам. Динорфины опосредуют негативные эмоциональные состояния, в том числе аверсию, дисфорию и депрессию. А еще динорфины повышают порог вознаграждения и угнетают высвобождение дофамина. Так же как и КРФ, активность динорфинов повышается при отмене ПАВ у лиц с аддикцией.
В принципе, здесь мы можем остановиться и задуматься вот над чем. Почему люди чаще всего пьют? «Хочу выпить сто грамм для аппетита». Хорошо. Еще? «Ну, вся компания пьет, и поэтому...» Ладно, еще? «Я устал, весь день у меня копился стресс, шеф вывел из себя, жена бесит, спина болит...» – есть такое? Ирония вот в чем: несмотря на то, что в краткосрочной перспективе ПАВ действительно могут снять напряжение, в то же время они активируют нейротрансмиссию КРФ, норадреналина и динорфинов. Это приводит к тому, что эмоциональное состояние зависимых ухудшается по нарастающему – у кого-то быстро и явно, у кого-то медленно и еле заметно. Алкоголь, героин, никотин и другие ПАВ не снимают стресс, а усиливают его, так как повышают уровень КРФ, норадреналина и динорфинов.
Лучше всего это показано в 5-минутном мультике Nuggets: идет по ровной поверхности птица киви, видит каплю, идет дальше. Видит еще одну каплю, пробует на вкус. И вдруг все вокруг становится солнечно-желтым, появляется чарующая музыка, киви взлетает и какое-то время порхает с блаженным видом. Потом эффект капли проходит, птица приземляется и шагает дальше. Время от времени ей встречаются такие же капли. Киви их выпивает. Желтый цвет, музыка, полет. Но с каждым разом полет более кратковременный, падения более жесткие, а окружение – вот это важно – становится все более темным и мрачным. Именно так выглядит мир для человека с чрезмерно активными стресс-системами амигдалы: мир для него серый и чуждый, многое навевает грусть, пугает или раздражает. Несчастной птице остается только одно: найти еще одну капельку, чтобы хоть на короткое время вернуть эфемерный желтый свет, не понимая, что мир так почернел именно из-за этих капель и что после каждой капли он станет еще чернее.
Очевидно, если продолжать употреблять ПАВ, изменения в стресс-системах амигдалы с годами будут только усиливаться. А если прекратить? Если убрать все ПАВ, пережить синдром отмены – дальше будет нормально? К счастью, да. Но не сразу. Есть такой термин: protracted abstinence. По-русски: подострая абстиненция. Люди, которые 10, 15, 20 лет увлеченно алкоголизируются, а потом перестают пить, не так быстро возвращаются в комфортное эмоциональное состояние – сенсибилизированной амигдале для восстановления нужны месяцы, а порой даже годы.
(Стоит добавить, что гиперактивация амигдалы возможна и при других состояниях, например, при посттравматическом стрессе или хронической боли. У таких людей аддиктивная уязвимость выше, а восстановление требует большего времени.)
4.
Что может быть хуже, чем негативное эмоциональное состояние из-за взъерошенной, потрепанной амигдалы? Самое неприятное, что я сам вынес из своего 15-летнего аддиктивного опыта, это быть неразумным в своих же глазах. Я не мог смириться с тем, что курю, но и не мог бросить. Дискомфорт, который мы испытываем, когда наше поведение не вяжется с нашими убеждениями, Леон Фестингер назвал когнитивным диссонансом. Правда, диссонанс исчезал в момент, когда я, проснувшись утром, делал заветную первую затяжку. Все знают о кошке Шредингера. Мою душу то царапала, то не царапала кошка Фестингера.
Под воздействием ПАВ дофаминовая трансмиссия подавляется не только в системе вознаграждения, но и в префронтальной коре. Из-за этого ухудшаются исполнительные функции: саморегуляция, принятие решений, гибкость в выборе и инициировании действий, присвоении значимости и контроль ошибок. Далее нейропластические изменения затрагивают и глутаматергическую передачу. Нарушенная трансмиссия дофамина и глутамата в префронтальных областях мозга ослабляет их способность противостоять сильным побуждениям или своевременно прекращать употребление. Эти эффекты объясняют, почему люди с зависимостью могут быть искренними в своем намерении прекратить употреблять ПАВ и в то же время быть неспособными следовать своему решению.
5.
Все, что происходит с нейронами базальных ганглий, амигдалы, префронтальной коры вследствие употребления ПАВ, находит отражение в желаниях, эмоциях, мыслях человека, на решения, которые он принимает, на поведение и жизнь. Что именно с нейронами происходит? Мы теперь знаем, что: усиливается экспрессия разных транскрипционных факторов, активируются гены, синтезируются белки, нервная клетка претерпевает морфологические и функциональные изменения, сенситизируясь к определенным сигналам. Эти изменения называются нейропластическими.
Нейропластичность – суть научения. Наш мозг не статичный орган, а сложная, постоянно меняющаяся система, умеющая приспосабливаться к решению возникающих задач. Так, это понятно, но что именно заболевает в мозге при зависимости? Ведь зависимость – это болезнь?
А вот по ответу на этот вопрос пока нет научного консенсуса. Да, мы можем найти диагноз «синдром зависимости» среди расстройств психики и поведения в Международной классификации болезней 10-го пересмотра. Мы можем найти клинические рекомендации по лечению зависимости. И заключить: раз этот диагноз попал в МКБ-10 и раз это лечат лекарствами, то это болезнь. По некоторым формальным признакам зависимость можно рассматривать как расстройство, я с этим согласен. А вот нейробиолог Марк Льюис не согласен. Свое несогласие он вынес в подзаголовок книги «Биология желания», он так и звучит: «Зависимость не болезнь». Дискуссия о природе зависимости меня захватила сильно, и я, похоже, буду писать отдельную книгу про это. Здесь лишь кратко отмечу вот что. Марк Льюис утверждает, что все, что лежит в основе аддикции, укладывается в понятие научения (learning): мозг нейропластически подстраивается под задачи поиска и употребление ПАВ. Мы можем по-разному относиться к этому научению, но это именно научение. Проще говоря, зависимость – это не то, чем заболел мозг, а то, чему он научился. Даже такие серьезные сторонники «теории болезни мозга» как Джордж Куб и Нора Волкоу в своих исследованиях обычно не пишут «поражение нейронов» – они пишут «нейроадаптационные изменения». Эти изменения экстремальные, аргументирует Кент Берридж, и у нас есть основания рассматривать зависимость как расстройство. Но тот же Кент Берридж и его коллега Терри Робинсон в своих публикациях о нейробиологии зависимости никогда не говорят о патологии нейронов – они говорят о сенсибилизации нейронов. Помимо крайних позиций в этой научной дискуссии есть и более взвешенные концепции, умело сочетающие черты обеих позиций. Так, Анке Снук предлагает рассматривать зависимость как нормальный феномен, внутри которого иногда бывает «болезнеподобная стадия».
Здесь я хочу закончить словами Кента Берриджа: «Может быть, это и весело: спорить о словах, о том, какие из них лучше всего описывают зависимость. Но, я думаю, споры о словах, например о том, следует ли говорить «болезнь мозга», а не о реальных особенностях и механизмах самой зависимости, легко могут стать ловушками и отвлечь нас от более важных целей. Эти цели должны состоять в том, чтобы определить основные черты и механизмы зависимости и подумать о лучших способах помочь зависимым».
Пока ученые между собой договариваются, мы можем извлечь из их дискуссии нечто, с чем согласны все стороны: в основе зависимости лежит научение нейронов и нейронных цепей. И сделать три практических вывода: 1) пока человек продолжает употреблять ПАВ, изменения, лежащие в основе зависимости, будут прогрессировать; 2) если перестать употреблять, эти процессы остановятся; 3) мозг способен учиться и меняться, а значит, в условиях воздержания от ПАВ он со временем перестроится и приспособится к решению других, полезных для жизни задач. Здесь важно понимать вот что: трезвость не цель, а условие для позитивных нейропластических изменений. Это и есть путеводная нить. Нет никакого смысла петь дифирамбы трезвости. Трезвость не самоцель. Но трезвость – непременное условие для того, чтобы активность стресс-систем амигдалы вернулась в норму, чтобы влечение к ПАВ постепенно ослабело, чтобы префронтальная кора вернула себе свои исполнительные функции. Трезвость – условие, чтобы вернуть себе себя и управлять своей жизнью. (Но об этом – в следующий раз.)
|









